2.1 Об измерении массы тел и молекул
Определение килограмма было утверждено на III Генеральной конференцией по мерам и весам в 1901 году и формулируется так:
Килограмм — единица массы, равная массе международного прототипа килограмма.
Килограмм пока остаётся последней единицей в Международной системе измерений (СИ), которая определена на основе объекта, изготовленного человеком. Однако, XXVI Генеральная конференция по мерам и весам (13 — 16 ноября 2018 года) одобрила новое определение килограмма, основанное на фиксации численного значения постоянной Планка. Решение вступит в силу 20 мая 2019 года. При этом с практической точки зрения величина килограмма не изменится, но существующий «прототип» (эталон) более не будет определять килограмм, а станет очень точной гирькой с потенциально измеримой погрешностью. Эта эталонная гирька представляет собой цилиндр диаметром и высотой 39,17 мм из платино-иридиевого сплава (90 % платины, 10 % иридия):

Он был выпущен Генеральной конференцией по мерам и весам в 1889 году на основе Метрической конвенции (1875) и хранится под надзором Международного бюро мер и весов, которое находится в городе Севр (пригород Парижа, Франция). Были изготовлены также точные официальные копии международного эталона, которые используются как национальные эталоны килограмма. Всего было создано более 80 копий. Две копии международного эталона были переданы России, они хранятся во ВНИИ метрологии им. Менделеева.
Таким образом, чтобы определить массу вещества (например, мешка картошки) нам понадобится специальный прибор - весы, а также эталоны измерения массы тела или проще говоря "килограммовые гирьки". Чтобы узнать массу вещества необходимо сравнить её с килограмовыми порциями массы (1 кг). На одну чашу весов надо положить мешок, а на другую подкладывать гирьки до тех пор, пока весы не уравновесятся. Сколько гирек окажется на чаше весов, значит столько весит мешок картошки в килограммах, так как мерили мы порциями в 1 кг. Для повышения точности измерения мы можем пользоваться также более мелкими гирьками, масса которых составляет доли от одного килограмма, например, граммовыми (тысячная доля от 1 кг) или милиграммовыми (милионная доля от 1 кг). Часто для измерения очень маленьких тел разумнее использовать гирьки массой 1 мг, а не 1 кг. Однако, даже такие маленькие порции эталона окажутся бесполезны для измерения массы частицы или молекулы. Например, масса электрона составляет ничтожные доли (10-31) от 1 кг. По этой причине для определения масс атомов и молекул применяют другой эталон, который называется атомная единица массы.
Атомная единица массы (а.е.м.) не является основной единицей измерения в системе СИ, но Международный комитет мер и весов относит её к единицам, допустимым к применению на равне с единицами СИ. За атомную единицу массы принята 1/12 массы изотопа углерода-12. Масса одного этого нуклида в единицах СИ равна mc=1,9927 × 10-26 кг, поэтому:
1 а.е.м. = (1/12)×mc = (1,9927 ×10-26)/12 = 1,6606 ×10-27кг.
2.2 Основные характеристики описания вещества
В статье "О теплообмене" уже отмечалось, что люди всегда пытались понять и объяснить природу тепла и холода. Тепловые явления были известны с тех пор, как появился первый огонь в виде костра, топливом для которого служили дрова и древесный уголь. На латинском языке "уголь" звучит как carbō(карбо) и является источником углерода, поэтому углеродные соединения часто называют "карбонами". От слова "уголь" в начале 19 века в русском языке появилось название "углетворящий" или "углетвор", а с 1824 года такое названием вещества окончательно заменили на слово "углерод". В зависимости от строения нуклона углерод может быть графитом (по др.-греч. значит "писать") и легко стираться при рисовании им на холсте, а также алмазом (по др.-греч. значит "несокрушимый") и легко резать толстое загаленное стекло.

Алмаз и графит являются одним и тем же веществом, только в разных формах его проявления. Алмаз, это вещество, которое под действием высоких температур и давления превращается из графита приобретая особые качества - твердость, прозрачность.
Углеродистые соединения сопровождали человека на протяжении всей его истории, то в качестве топлива, то в качестве письменного прибора, то в качестве драгоценного камня. И всякий раз углерод был предметом исследования для многих ученых и мыслителей разных эпох, так как проявлял очень разные свойства. Поэтому нет ничего удивительного, что именно атом углерода был взят в качестве "эталона" для количественной оценки основных характеристик молекулярного строения вещества.
а) Количество вещества — v [моль]
Как известно вещества состоят из молекул, а молекулы состоят из атомов. От количества атомов в молекулах зависит не только масса, но и агрегатное состояние (твёрдое, жидое или газообразное) вещества. Вот почему важно знать количество вещества.
Понятно, что атомов очень много, а помому посчитать их количество трудно. Гораздо удобнее выделить определённую порцию, которая выступит в качестве единичного эталона, то есть некоторой неизменной величины, с которой будем сравнивать все остальные количества. Например, если общее число молекул в веществе N разделить на этот эталон, то мы увидем сколько раз эта единичная порция повторяется в нашем веществе. Число повторений порции позволит измерить количество вещества в молях.
Исходя из выше сказанного, были взяты 12 грамм чистого изотопа углерода-12, в котором насчитали 6,022⋅1023 атомов. Это число атомов и было принято в качестве единичной порции, то есть эталона, которым будут мерить число молекул в любом другом веществе. Углерод имеет несколько изотопов, но наибольшее распространенность в природе (порядка 98,93 %) получил именно углерод-12, указанный в таблице химических элементов имени Д.И.Менделеева под порядковым номером "6".

Таким образом, получается, что 12 грамм углерода-12 содержат 6,022⋅1023 атомов, что соответствует 1 молю, принятого за единицу измерения количества любого вещества. Указанное число атомов, принятое неизменной величиной для любого вещества, было открыто в 1811 году итальянским учёным Амедео Авогадро и названо в его честь "числом Авогадро" (или "постоянной Авогадро").
Количество вещества v – это физическая величина, характеризующая количество однотипных структурных единиц , содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы,ионы и др.). Единица измерения количества вещества в системе СИ - 1 моль.
Моль – это такое количество вещества, в котором содержится число частиц (атомов или молекул), равное числу атомов, содержащихся в 12 г углерода-12.
Постоянной Авогадро NA= 6,022⋅1023 моль-1 называется число структурных единиц в 1 моле вещества.
N - число молекул в данном веществе.
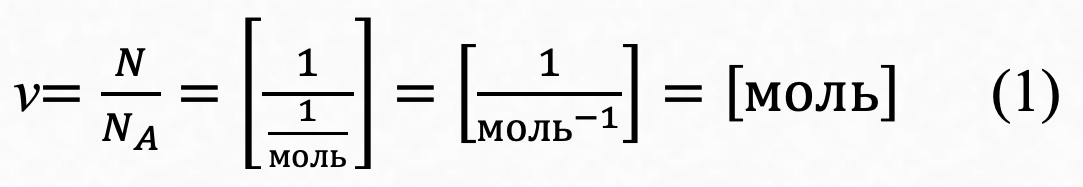
б) Масса вещества
Одним из фундаментальных свойств атома является его масса. Абсолютная масса атома — величина, чрезвычайно малая. Так, атом водорода имеет массу около 1,67⋅10−24 г.
Если вещество состоит из одинаковых молекул, масса каждой из которых равна m0 , а общее их число составляет N, тогда масса всех молекул вещества m, выражаться формулой:
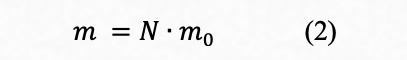
Однако на практике преимущественно и значительно удобнее пользоваться условной величиной, которая показывает, во сколько раз масса атома m0 данного элемента больше массы атома другого элемента, принятой за единицу измерения массы. Особенно, когда речь идет о сложных молекулах
Относительная молекулярная масса — Мr
В качестве единицы измерения относительных атомных (Аr ) и молекулярных (Мr ) масс (где "r" – от англ. "relative"–относительный) принята 1⁄12часть массы атома углерода-12. В современной научной литературе относительная атомная масса и атомный вес – синонимы, и именно эти массы указаны в таблице Д.И.Менделеева. Относительная молекулярная масса представляет собой отношение массы какого-нибудь атома m0 к атомной единице масс (1 а.е.м. = 1,6606 ×10-27кг):
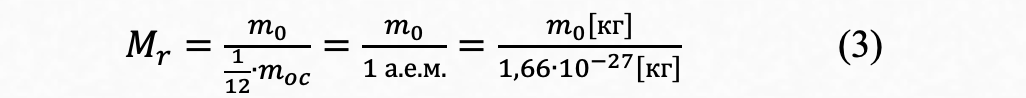
Относительная молекулярная масса, фактически, безразмерная величина, поэтому единицы измерения "а.е.м." после численного значения обычно опускают (но можно и написать, в этом не будет ошибки). Относительные молекулярные массы сложных молекул можно определить, просто складывая относительные атомные массы входящих в них элементов.
Молярная масса — М [кг/моль]
Если в выражении (2) общее число молекул равно 6,022⋅1023, то это означает, что речь идет о числе Авогадро, которое соответствует одной порции количества вещества равной одному молю и формула примет вид:
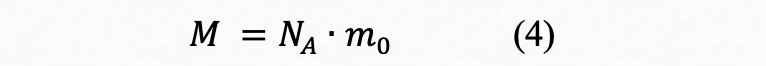
где М - масса одного моля вещества, называемая молярной массой. Из формулы (4) хорошо видна размерность молярной массы:
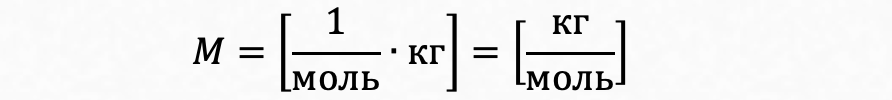
В Международной системе единиц (СИ) единицей измерения молярной массы является "килограмм на моль" (кг/моль), но исторически сложилось, что молярную массу, как правило, выражают в г/моль. Кроме того молярная масса численно совпадает с относительной молекулярной массой. Однако надо чётко представлять разницу между молярной массой и относительной молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности.





Поделиться с друзьями: